 |
 | ||
|
| |||
|
Au cours de cette compétition, nous allons préparer le sulfate d’ammonium et de magnésium en dissolvant dans
l’eau des quantités stoechiométriques de sulfate d’ammonium et de sulfate de magnésium
(formule (NH4)2Mg(SO4)2.6H2O [le point devant
6H2O signifie que les molécules d’eau sont co-cristallisées]). En fait, le sulfate d’ammonium et de
magnésium est un sel double. Sa formation peut être décrite par l’équation chimique suivante :
(NH4)2SO4 + MgSO4 → (NH4)2Mg(SO4)2 Le sel double formé cristallise avec 6 molécules d’eau dans l’unité de formule. Dans la nature, on trouve le sulfate d’ammonium et de magnésium sous la forme d’un minéral dénommé boussingaultite. Ce minéral se présente comme un agrégat de cristaux prismatiques de couleur blanche dont la dureté est de 2 (comparable au gips) et la densité 1.72 g/cm3. Le nom du minéral a pour origine le chimiste français Jean-Baptiste Joseph Dieudonné Boussingault (1802-1887), professeur à l’université de Lyon.
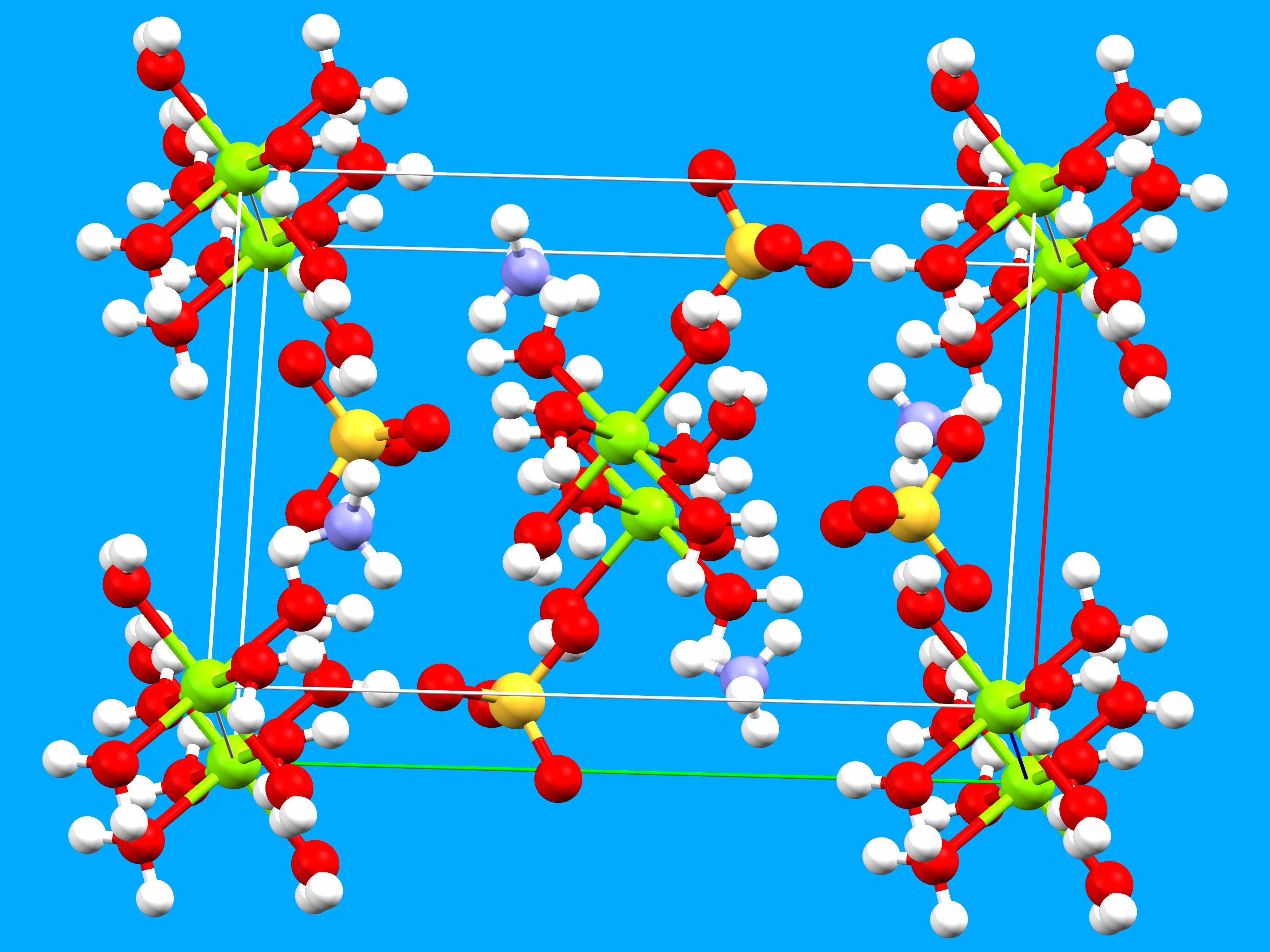
Le sulfate d’ammonium et de magnésium cristallise dans le système monoclinique avec les paramètres de maille élémentaire suivants : a = 9.324 Å, b = 12.597 Å, c = 6.211 Å (1 Å est égal à 10-10 mètres, soit 0,000.000.000.1 m) ; l’angle beta vaut 107.14°. La structure est construite à partir de trois entités : un groupe ammonium, le magnésium hexahydraté et un groupe sulfate .
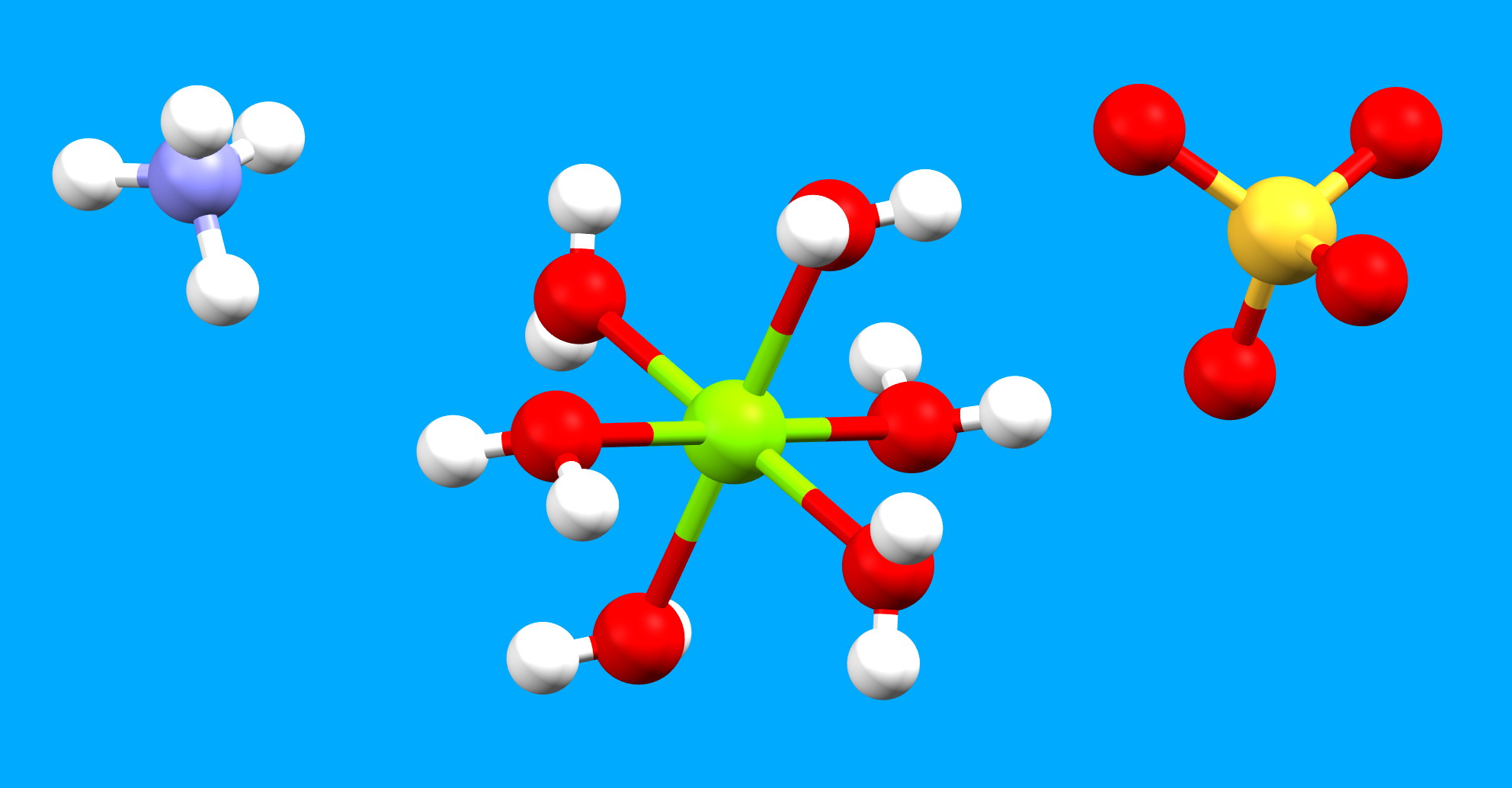
Aux sommets de la maille et au milieu de la face (a-b), se trouvent les atomes de magnésium. Ils sont entourés chacun de 6 molécules d’eau. Cet entourage est appelé octaédrique car les 6 atomes d’oxygène des molécules d’eau occupent les sommets d’un octaèdre au centre duquel se situe l’atome de magnésium. Les distances oxygène – magnésium varient de 2.051 à 2.083 Å. Dans la figure ci-dessus, les codes de couleur des atomes sont : Mg en vert, O en rouge, S en jaune, N en bleu et H en blanc. Pour la maille élémentaire, a est de couleur rouge, b vert et c bleu.
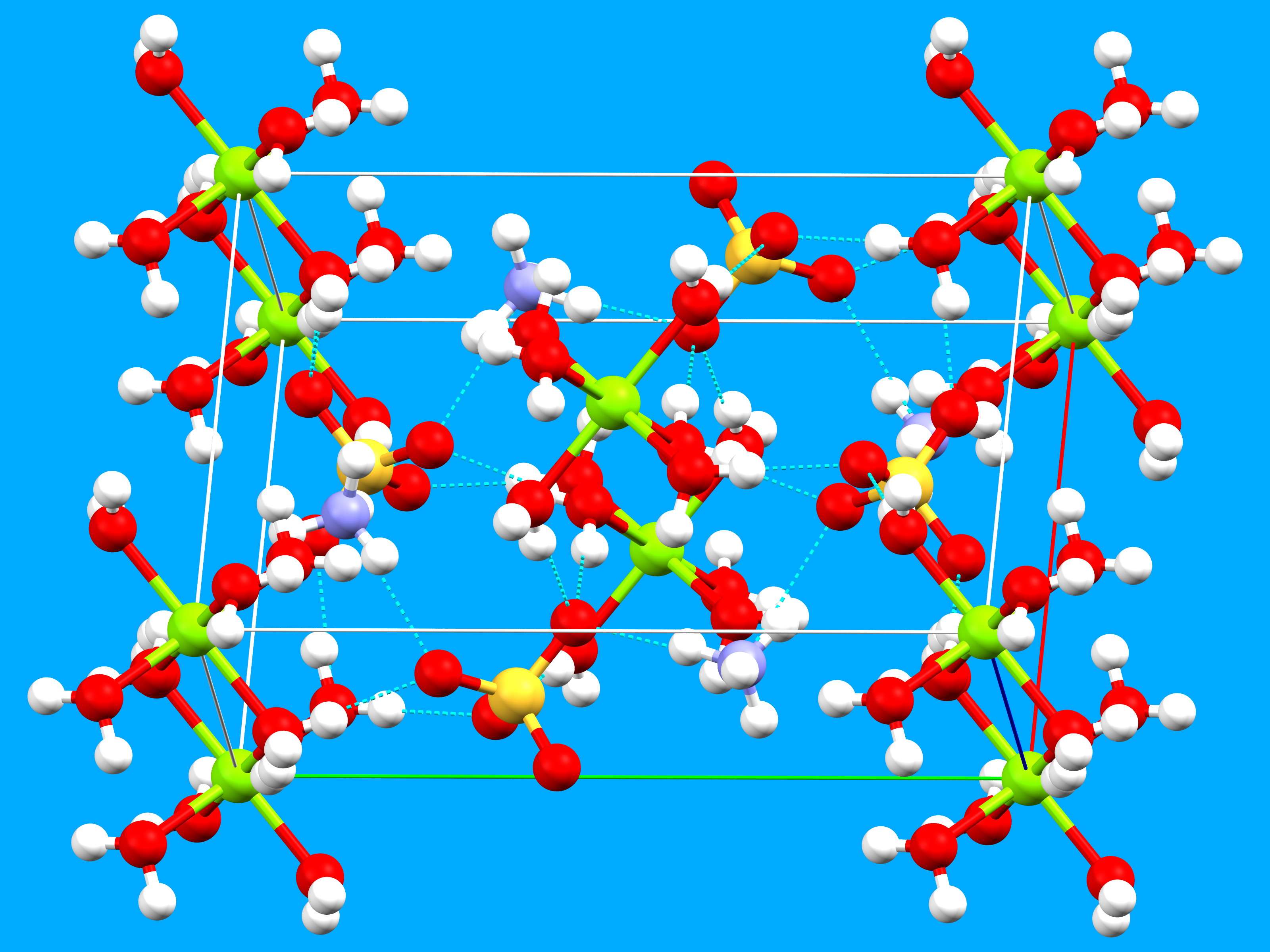
Entre les atomes de magnésium, on trouve en alternance les groupes ammonium et sulfate. Pour ces groupes, l’atome en position centrale (azote ou soufre) est entouré de manière tétraédrique (respectivement par des atomes d’hydrogène ou d’oxygène). Un réseau de liaisons hydrogène entre les anions chargés négativement et les cations chargés positivement stabilise l’arrangement cristallin. Les atomes d’hydrogène des molécules d’eau et des groupes ammonium agissent comme donneurs alors que les atomes d’oxygène des groupements sulfates sont les accepteurs. La figure ci-dessous montre les liaisons hydrogène représentées par des lignes en bleu pointillées.
|

Page Design: Luc Van Meervelt - Translation: Bernard Tinant
Information Provider: National Committee for Crystallography
Comments for the Author: Luc Van Meervelt
http://www.chem.kuleuven.be/bcc/AMS-F.html